
O princípio de Le Chatelier nos diz que quando uma perturbação é causada a um sistema em equilíbrio, ele se deslocará no sentido que minimize as forças criadas por essa perturbação e se restabeleça um novo equilíbrio químico.
Uma dessas perturbações é a variação da temperatura. Essa variação é importante porque, além de provocar o deslocamento do equilíbrio, ela também irá alterar o valor da constante do equilíbrio, Kc.
Para você entender melhor como isso ocorre, vejamos um exemplo:
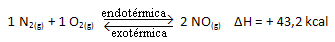
Kc = _[ NO]2___
[N2] . [O2]
A reação acima ocorre no sentido direto com absorção de energia, ela é endotérmica. O processo inverso, por outro lado, ocorre com liberação de energia, sendo uma reação exotérmica.
Assim, se aumentarmos a temperatura do sistema, o equilíbrio químico será deslocado no sentido da reação endotérmica, que nessa reação é para a direita. Isso ocorre para que o calor seja absorvido e se atinja novamente o equilíbrio.
O contrário também é verdadeiro; se diminuirmos a temperatura desse sistema, a reação se deslocará para o sentido que irá liberar calor, porque a energia total da reação irá reduzir. Isso significa que o equilíbrio se deslocará no sentido da reação exotérmica, que nesse caso é para a esquerda:
Resumindo:
Em relação à constante de equilíbrio (Kc), quando a temperatura aumenta, isso favorece a reação endotérmica e mais NO(g) é formado, aumentando a sua concentração e diminuindo a concentração dos reagentes. Observe na fórmula abaixo que a concentração de NO(g) é diretamente proporcional à constante Kc, por isso, ela também aumenta:
Mas se diminuirmos a temperatura, deslocando a reação no sentido da reação exotérmica, a concentração do produto NO irá diminuir e as concentrações dos reagentes irão aumentar. Visto que as concentrações dos reagentes são inversamente proporcionais à constante Kc, então ela irá diminuir:
Por Jennifer Fogaça
Graduada em Química
