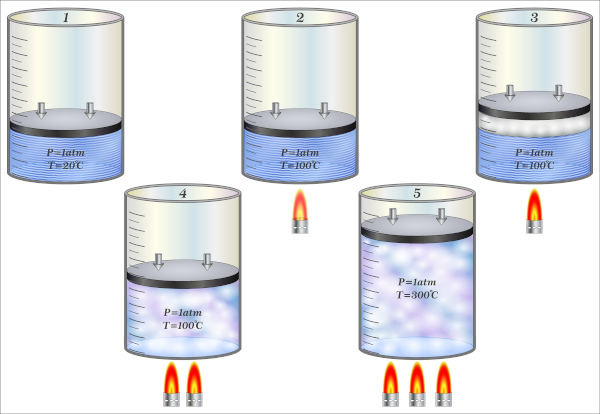
Acontece a transformação isocórica quando determinada massa de um gás é submetida a mudanças de temperatura que desencadeiam mudanças de pressão ou vice e versa, considerando-se que temperatura e pressão, nesse caso, são grandezas diretamente proporcionais, enquanto o volume do sistema permanece inalterado.
Veja também: O que é pressão parcial dos gases?
O que é uma transformação isocórica?
Uma transformação isocórica é quando acontece a uma determinada massa de gás uma mudança de temperatura e pressão, mas seu volume continua o mesmo. A alteração de pressão será diretamente proporcional à temperatura, ou seja, se um gás, em um determinado sistema fechado, dobrar sua temperatura absoluta, isso acarretará um aumento da pressão para o dobro do que havia inicialmente.
Esse tipo de transformação é também chamado de isovolumétrico ou isométrico. O termo isocórico provem do grego Isokhora, em que iso significa “igual” e khora significa “lugar ou volume” (nesse contexto).
Exemplos:
Os pneus de um carro sofrem transformação isocórica, podemos observar isso ao fazermos sua calibragem. Em dias quentes, a pressão dada no monitor de calibragem é maior do que em dias frios. Isso porque, havendo aumento na temperatura, a pressão aumenta, já que o volume mantém-se.

Outros exemplos são os desodorantes em spray, nesse tipo de produto há, no rótulo, um aviso para que não seja armazenado ou submetido a altas temperaturas, pois, além de algumas de suas substâncias serem inflamáveis, há a condição de transformação isocórica ou isovolumétrica. Como os desodorantes em aerossol estão dentro de um frasco vedado e em estado gasoso, o aumento da temperatura acarretará um aumento de pressão e o risco de uma explosão.
Características de uma transformação isocórica
- Volume constante.
- Pressão e temperatura são diretamente proporcionais.
Essas características podem ser descritas pelas seguintes fórmulas:
Gráfico de uma função isocórica
Observe a seguinte tabela que descreve o comportamento de um gás em relação à pressão, à temperatura e à constante resultante.
|
Temperatura (°C) |
Pressão (atm) |
P/T = constante |
|
50 |
5 |
10 |
|
100 |
10 |
10 |
|
150 |
15 |
10 |
|
200 |
20 |
10 |
Observe que a pressão acompanha o aumento da temperatura de forma que a relação P/T permanece constante, isso quer dizer que pressão e temperatura são grandezas diretamente proporcionais. Portanto, o gráfico que descreve transformações isocóricas é do tipo linear. Veja:
Quem descobriu a transformação isocórica?
Jacques Alexandre César Charles (1746-1823) foi o cientista francês que, estudando o comportamento dos gases em sistema fechado para criação de um termômetro de precisão, concluiu os estudos sobre as transformações isocóricas.
O cientista Joseph Louis Gay-Lussac (1778-1850) também desenvolveu um estudo sobre expansão e retração de um sistema gasoso. Foram análises independentes, mas que, por chegarem à mesma conclusão, dividiram os créditos. Hoje alguns autores referem-se às duas últimas leis físicas dos gases que explicam as transformações isobáricas e isocóricas como 1ª e 2ª leis de Charles-Gay-Lussac.
Veja também: Lei volumétrica de Gay-Lussac
Exercícios resolvidos
Questão 1 - (PUC-RJ) Um pneu de bicicleta é calibrado a uma pressão de 4 atm, em um dia frio, à temperatura de 7 °C. O volume e a quantidade de gás injetado são os mesmos. Qual será a pressão de calibração no pneu quando a temperatura atinge 37 °C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Resolução
Alternativa A
1° passo: identificar o sistema e extrair os dados.
Sistema isovolumétrico
P1 = 4 atm
T1 = 7 °C
T2 = 37 °C
P2 = ?
Utilizando a fórmula:
7 x P2 = 37 x 4
P2 = 148 / 7
P2 = 21,14 atm
Questão 2 - (Unifor-CE) Examine a figura abaixo.
A pressão do gás dentro da seringa pode ser diminuída:
a) colocando a seringa em água gelada, mantendo a extremidade tampada.
b) apertando o êmbolo, mantendo a extremidade tampada.
c) colocando a seringa em água quente, mantendo a extremidade tampada.
d) abrindo a extremidade e expulsando metade do ar para fora da seringa.
e) puxando o êmbolo, mantendo a extremidade aberta.
Resolução
Alternativa A. A pressão de um gás é diretamente proporcional à temperatura em sistema isocórico, ou seja, sem alteração de volume ou de massa do gás. Quando houver diminuição na temperatura, haverá também uma queda na pressão.
Por Laysa Bernardes Marques de Araujo
Professora de Química