
As substâncias iônicas são aquelas que possuem pelo menos uma ligação iônica, ou seja, quando há transferência definitiva de elétrons de um dos átomos para outro, formando íons. O átomo do elemento que perdeu os elétrons fica com carga positiva e é um íon chamado de cátion, enquanto o átomo que recebeu os elétrons, ficando com carga negativa, é o ânion.
Existem íons simples (formados apenas por um átomo) e íons compostos (formados por grupos de átomos de elementos químicos diferentes que, juntos, ganharam ou perderam um ou mais elétrons). A seguir temos uma tabela com a lista dos ânions e cátions, simples e compostos, que formam os compostos iônicos.
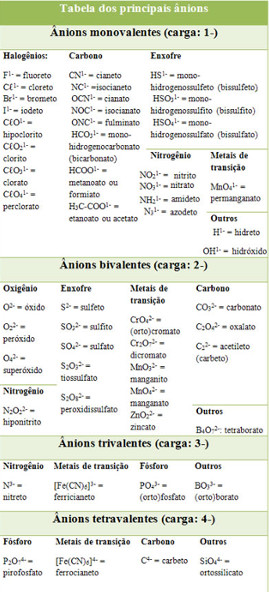
Tabela de ânions que formam as substâncias iônicas
Tabela de cátions que formam as substâncias iônicas
Entre os ânions mostrados acima, os mais importantes são: cloreto, carbonato, nitrato e sulfato. Eles ligam-se com elementos menos eletronegativos que eles e formam os principais sais encontrados na natureza e em nosso cotidiano. O cloreto é um ânion simples, enquanto os demais grupos são todos ânions compostos.
Os sais são substâncias iônicas inorgânicas que, segundo a teoria da dissociação eletrolítica de Arrhenius, podem ser definidos como compostos que em meio aquoso liberam pelo menos um cátion diferente de H+ (ou H3O+) e pelo menos um ânion diferente de OH-.
Os sais formados por ânions compostos possuem ligações iônicas e covalentes, sendo que os ânions são formados por ligações covalentes (com compartilhamento de elétrons), e a ligação entre esses ânions e um metal ou um semimetal é iônica.
Por exemplo, o nitrato de sódio (NaNO3) é formado pela ligação iônica entre o cátion sódio (Na+) e o ânion nitrato (NO3-), ocorrendo a transferência de um elétron. Observe abaixo que há essa ligação iônica, mas a ligação que forma o ânion é covalente:
Esta, porém, é só a fórmula unitária. As substâncias iônicas ficam unidas, na verdade, formando grandes aglomerados de formas geométricas bem definidas que são chamados de retículos cristalinos. Isso acontece em virtude da atração eletrostática que há entre essas cargas de sinais opostos, os íons acabam se atraindo aos que estão mais próximos, formando esses retículos, em que vários ânions ficam ao redor de um cátion e vice-versa. A quantidade de íons que fica ao redor de um íon de carga oposta é chamada de número de coordenação.
Por exemplo, a seguir temos o sal sulfato de cobre (CuSO4) e uma ilustração do seu retículo cristalino:
Em razão desses arranjos, as substâncias iônicas possuem as seguintes propriedades principais:
-
São sólidas em temperatura ambiente;
-
Apresentam elevados pontos de fusão e ebulição;
-
São duras e quebradiças;
-
Conduzem corrente elétrica quando dissolvidas na água e quando fundidas.
Abaixo temos os textos que explicam sobre como os ânions cloretos, carbonatos, nitratos e sulfatos se formam, sua constituição, propriedades, fontes, importância, aplicações e exemplos de substâncias iônicas que os contêm. Acesse cada um deles para ficar por dentro de todos esses detalhes:
* Cloretos;
* Carbonatos;
* Nitratos;
* Sulfatos.
Por Jennifer Fogaça
Graduada em Química
