
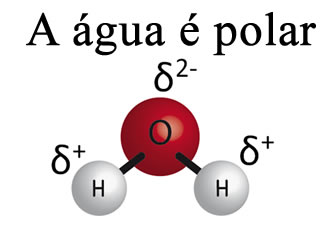
A água sozinha não consegue remover a gordura dos materiais. Isso acontece porque a água é polar, conforme mostrado na imagem abaixo, em virtude da diferença de eletronegatividade que existe entre os átomos de hidrogênio e oxigênio de suas moléculas. Por outro lado, a gordura é apolar e, por isso, a água não dissolve as gorduras.
Além disso, a água possui algo chamado de tensão superficial. Você poderá entender melhor sobre isso no texto Tensão Superficial da Água, mas, basicamente, trata-se de uma espécie de película ou membrana elástica que se forma na superfície da água, que a impede de penetrar em tecidos e outros materiais para remover a sujeira. As moléculas de água atraem-se em todas as direções por meio de ligações de hidrogênio, mas as moléculas da superfície só interagem com moléculas do lado e abaixo, criando uma diferença de forças de coesão, que faz com que as moléculas da superfície contraiam-se e formem essa tensão superficial.
É aí que entram os sabões e detergentes (do latim detergere = limpar), que são também chamados de agentes tensoativos, pois possuem a capacidade de diminuir a tensão superficial da água e, além disso, interagem tanto com a água quanto com a gordura. Como isso ocorre?
Os sabões e detergentes possuem sais de ácidos graxos, que são longas moléculas formadas por uma parte apolar (que é hidrofóbica – hidro = água; fobos = aversão) e uma extremidade polar (hidrófila – hidro = água; filos = amigo). Abaixo temos uma estrutura típica de um sabão:
Geralmente, os detergentes são sais de ácidos sulfônicos de cadeia longa:
Assim, a parte apolar dessas moléculas presentes nos sabões e detergentes interage com a gordura, enquanto a extremidade polar interage com a água, agrupando-se na forma de pequenos glóbulos, denominados de micelas, em que as partes hidrofílicas ficam voltadas para a parte de fora da micela em contado com as moléculas de água, e a gordura fica na parte interna, em contato com a parte apolar ou hidrofóbica, processo semelhante ao que mostra a imagem a seguir:
Desse modo, as sujeiras gordurosas são aprisionadas no centro das micelas e podem ser removidas. Outro ponto é que os detergentes e os sabões têm a capacidade de diminuírem a tensão superficial da água, porque diminuem as interações entre as suas moléculas, facilitando, assim, que ela penetre em vários materiais para remover a sujeira.
Por Jennifer Fogaça
Graduada em Química
