Pilhas e baterias são dispositivos essenciais em nosso cotidiano e que basicamente convertem energia química em energia elétrica por meio de reações de oxirredução espontâneas. As pilhas são formadas por unidades simples que geram eletricidade por meio de uma reação química entre dois eletrodos imersos em um eletrólito. As baterias são formadas por um conjunto de pilhas conectadas em série ou paralelo, aumentando a capacidade ou a tensão disponível.
Leia também: Energia elétrica — detalhes sobre um dos principais tipos de energia utilizados no mundo
Resumo sobre pilhas e baterias
- Pilhas e baterias são dispositivos que convertem energia química em energia elétrica por meio de reações de oxirredução.
- As pilhas consistem em uma única célula galvânica, enquanto as baterias podem ter múltiplas células conectadas em série ou paralelo.
- Os principais componentes incluem ânodo, cátodo, eletrólito, separador e invólucro.
- O ânodo é o polo negativo, no qual ocorre a oxidação, e o cátodo é o polo positivo, em que ocorre a redução.
- O eletrólito permite o fluxo de íons entre os eletrodos, completando o circuito interno.
- As pilhas são geralmente descartáveis, enquanto as baterias podem ser recarregáveis, como as de íon-lítio, usadas em celulares.
- As aplicações variam desde pequenos dispositivos eletrônicos até veículos elétricos e sistemas de energia solar.
- As vantagens incluem portabilidade, confiabilidade e versatilidade, mas apresentam desvantagens, como poluição ao descarte e variação de desempenho conforme a temperatura.
O que são pilhas e baterias?
As pilhas e baterias são dispositivos que convertem energia química em energia elétrica por meio de reações de oxirredução. Sua principal finalidade é a alimentação de dispositivos portáteis e sistemas que necessitam de energia constante.
Em meio a isso, é importante fazermos uma distinção entre elas. As pilhas são formadas por unidades simples que geram eletricidade por meio de uma reação química entre dois eletrodos imersos em um eletrólito. As baterias, por sua vez, consistem em um conjunto de pilhas conectadas em série ou paralelo, aumentando a capacidade ou a tensão disponível.
Diferenças entre pilhas e baterias
Embora tanto as pilhas quanto as baterias possam gerar eletricidade por meio de reações químicas, existem algumas diferenças significativas entre elas, as quais destacamos no quadro abaixo:
|
Características |
Pilhas |
Baterias |
|
Estrutura |
Unidade única |
Conjunto de múltiplas pilhas |
|
Capacidade de energia |
Quantidade limitada de energia |
Maior capacidade de armazenamento |
|
Reutilização |
Geralmente descartáveis (não recarregáveis) |
Podem ser recarregáveis, como as de íon-lítio. |
|
Aplicação |
São dispositivos menores e de baixo consumo. |
São geralmente dispositivos maiores e mais exigentes. |
|
Tensão |
Fornecem baixa tensão fixa. |
Podem fornecer maior tensão, dependendo da conexão. |
Para saber mais sobre as diferenças entre pilhas e baterias, clique aqui.
Componentes das pilhas e das baterias
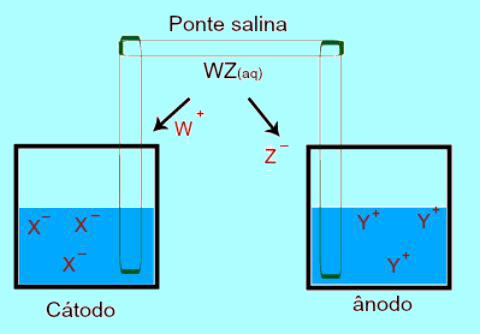
Os principais componentes que integram as pilhas e baterias são os eletrodos, o eletrólito e o separador. Nesse sentido, os eletrodos são geralmente compostos por um ânodo e um cátodo, os quais permitem a ocorrência das reações de oxirredução, conforme é ilustrado na figura abaixo:
De modo que o ânodo (polo negativo) é o eletrodo em que ocorre a oxidação, liberando elétrons, enquanto o cátodo (polo positivo) é o eletrodo em que ocorre a redução, recebendo elétrons, os quais fluem através de um circuito externo, gerando corrente elétrica, conforme ilustrado a seguir:
Já o eletrólito é uma substância condutora que permite o fluxo de íons entre os eletrodos, completando o circuito interno da pilha ou bateria. Pode ser sólido, líquido ou pastoso, dependendo do tipo de dispositivo. O separador, por sua vez, é um material que impede o contato direto entre o ânodo e o cátodo, evitando curtos-circuitos, mas ainda permitindo o movimento de íons entre eles. Além desses componentes principais, algumas pilhas e baterias podem conter outros elementos, como invólucros metálicos para proteger e manter a integridade dos componentes internos, além de materiais que ajudam a controlar a reação química e melhorar a eficiência do dispositivo.
Tipos de pilhas e baterias
Os tipos de pilhas e baterias variam principalmente de acordo com o material utilizado em seus componentes e com a finalidade de uso, podendo ser classificados como:
- Pilhas alcalinas: são utilizadas em dispositivos de baixo consumo, como controles remotos e brinquedos.
- Pilhas de zinco-carbono: são econômicas, mas têm menor durabilidade, sendo usadas em dispositivos simples, como os citados para as pilhas alcalinas.
- Baterias de chumbo-ácido: são comuns em automóveis e usadas para alimentar sistemas elétricos de veículos.
- Baterias de íon-lítio: são recarregáveis, têm alta densidade de energia, e são usadas em smartphones, laptops e outros dispositivos portáteis.
- Baterias de níquel-cádmio (NiCd): são recarregáveis e são usadas em ferramentas elétricas e alguns eletrônicos portáteis.
- Baterias de níquel-hidreto metálico (NiMH): são recarregáveis, têm maior capacidade que as de NiCd. Também são utilizadas em eletrônicos portáteis e ferramentas elétricas.
Função das pilhas e baterias
A principal função das pilhas e baterias é fornecer energia elétrica para uma ampla variedade de dispositivos eletrônicos, mesmo quando eles não estão conectados diretamente a fontes de energia. Dessa forma, elas permitem a utilização de eletrônicos em qualquer lugar, até mesmo no espaço ou em outro planeta, como é o caso das estações espaciais e dos robôs de exploração interplanetária. Além disso, outra função primordial delas é servirem como uma forma de armazenamento reserva de energia em casos de emergência.
Uso das pilhas e das baterias
As pilhas e baterias têm uma ampla gama de usos, sendo aplicadas em diversos dispositivos e sistemas que requerem energia portátil e confiável, logo, elas são fundamentais, permitindo o funcionamento de diversos dispositivos sem a necessidade de conexão à rede elétrica, como é o caso dos exemplos abaixo:
- Eletrônicos portáteis: usadas em celulares, laptops, tablets, relógios, controles remotos, brinquedos, entre outros.
- Veículos: alimentam motores e sistemas elétricos de automóveis, motocicletas e outros veículos.
- Sistemas de backup de energia: mantêm equipamentos críticos em funcionamento durante interrupções de energia.
- Dispositivos médicos: alimentam marcapassos, desfibriladores e outros dispositivos médicos que requerem alta confiabilidade.
- Equipamentos industriais: utilizadas em ferramentas elétricas, sensores e outros dispositivos industriais.
- Fontes de energia de emergência: usadas em lanternas, rádios de emergência e sistemas de comunicação em situações de falta de energia.
Importância das pilhas e das baterias
A importância das pilhas e baterias é percebida no funcionamento dos dispositivos e tecnologias que utilizamos diariamente. Por exemplo, elas proporcionam mobilidade e conveniência no uso de aparelhos portáteis, bem como garantem que equipamentos médicos, sistemas de segurança e outros dispositivos continuem funcionando durante quedas de energia, o que pode ser vital em emergências.
Além disso, essa importância se estende ao desenvolvimento de tecnologias mais sustentáveis, como os veículos elétricos, que dependem de baterias recarregáveis de alta capacidade para substituir combustíveis fósseis e reduzir a emissão de poluentes. Dessa forma, elas contribuem significativamente para avanços tecnológicos e para a sustentabilidade ambiental, mostrando-se indispensáveis para a manutenção da nossa vida moderna, não apenas permitindo o funcionamento de dispositivos essenciais como também impulsionando a inovação e a sustentabilidade.
Vantagens e desvantagens das pilhas e das baterias
Se, por um lado, podemos citar vários exemplos dos benefícios proporcionados pelas pilhas e baterias, por outro, no que tange ao contexto ambiental, cientistas ainda trabalham para aprimorar os métodos de reciclagem do material inutilizado em decorrência da vida útil expirada. Com base nisso, separamos, a seguir, algumas vantagens e desvantagens desses dispositivos:
→ Vantagens das pilhas e das baterias
- Permitem o uso de aparelhos eletrônicos em qualquer lugar sem a necessidade de conexão à rede elétrica e garantindo seu funcionamento adequado.
- São usadas em uma ampla variedade de dispositivos, desde pequenos eletrônicos até grandes sistemas industriais.
- Em sistemas de backup, mantêm equipamentos em funcionamento durante quedas de energia.
- Baterias recarregáveis são essenciais em veículos elétricos, promovendo alternativas mais limpas aos combustíveis fósseis.
→ Desvantagens das pilhas e das baterias
- O descarte inadequado pode causar poluição devido a metais pesados e substâncias tóxicas presentes em algumas delas.
- Baterias recarregáveis, especialmente as de alta capacidade, podem ser caras de produzir e adquirir.
- A maioria tem uma vida útil limitada, exigindo substituições frequentes, especialmente em dispositivos que consomem muita energia.
- O desempenho delas pode variar conforme as condições de temperatura, afetando a eficiência e a duração da carga.
Exercícios resolvidos sobre pilhas e sobre baterias
Questão 1
(INQC – 2023) Uma pilha eletroquímica é um dispositivo que converte ________________ em energia elétrica por meio de reações eletroquímicas. Ela consiste em dois eletrodos (um ânodo e um cátodo) imersos em um ___________. As reações químicas nos eletrodos resultam no fluxo de elétrons através de um circuito externo, gerando ____________.
Assinale a alternativa que cujas palavras ou expressões completam corretamente as lacunas da frase.
A) Energia cinética – Eletrodo – Corrente elétrica.
B) Energia química – Eletrodo – Oxidação.
C) Energia química – Eletrólito – Corrente elétrica.
D) Energia potencial – Eletrólito – Redução.
E) Energia química – Potencial – Oxidação.
Resolução:
Alternativa C
Uma pilha produz energia elétrica por meio de energia química. Isso ocorre pela transferência de elétrons nas reações que ocorrem nos eletrodos imersos em um eletrólito, gerando corrente elétrica que flui por um circuito externo.
Questão 2
(Seduc) Pilha é um dispositivo eletroquímico que aproveita a espontaneidade de uma reação de oxirredução para produzir trabalho. Esse trabalho, diferentemente de uma expansão gasosa, é realizado dentro de um circuito elétrico. A célula eletroquímica característica de reações espontâneas é a
A) galvânica.
B) eletrolítica.
C) oxidativa.
D) redutiva.
E) potenciométrica.
Resolução:
Alternativa A
A) galvânica — produz eletricidade por meio de uma reação de oxirredução espontânea (célula galvânica ou voltaica).
B) eletrolítica — uma corrente elétrica externa força uma reação de oxirredução no sistema, ou seja, uma reação não espontânea, também conhecida como eletrólise (célula eletrolítica).
C) oxidativa — não é uma célula eletroquímica. O termo se refere ao tipo de reação em que houve perda de elétrons.
D) redutiva — repete-se o sentido da alternativa anterior, mas aqui o termo se refere ao tipo de reação em que houve ganho de elétrons.
E) potenciométrica — refere-se a métodos ou técnicas que envolvem a medição de potencial elétrico (ou tensão).
Créditos de imagem
[1] Roberto Sorin / Shutterstock
[2] rafastockbr / Shutterstock
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. As células galvânicas. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 545–546.
BOCCHI, N.; FERRACIN, L. C.; BIAGGIO, S. R. Pilhas e Baterias: Funcionamento e Impacto Ambiental. Quimíca Nova Escola, v. 11, p. 3–9, 2000.
BORAH, R. et al. On battery materials and methods. Materials Today Advances, 2020.
CÂMERA, S. C. et al. Simulação do intemperismo natural de pilhas zinco-carbono e alcalinas. Química Nova, v. 35, n. 1, p. 82–90, 2012.
FICHTNER, M. et al. Rechargeable Batteries of the Future — The State of the Art from a BATTERY 2030+ Perspective. Advanced Energy Materials, 2022.
OLIVEIRA, B.; CARRIELO, S.; CARLOS, J. Série histórica da composição química de pilhas alcalinas e zinco-carbono fabricadas entre 1991 e 2009. Química Nova, v. 34, n. 5, p. 812–818, 2011.
PAULINO, J. F.; GIOVANINI, N.; CARLOS, J. Processamento de pilhas Li/MnO2 usadas. Química Nova, v. 30, n. 3, p. 718–722, 2007.
PORZIO, J.; SCOWN, C. D. Life-Cycle Assessment Considerations for Batteries and Battery Materials. Advanced Energy Materials, 2021.