
Utilizando uma ampola de Crookes, isto é, tubos de vidro fechados com um eletrodo positivo e outro negativo, contendo gases a pressões extremamente baixas; o cientista inglês Joseph John Thomson (1856-1940) fez uma descoberta imprescindível para a evolução do modelo atômico.
Ele submeteu estes gases a voltagens elevadíssimas, desse modo foi possível observar o aparecimento de emissões, que foram denominadas raios catódicos. Em seguida, foi colocado um campo elétrico externo e, por fim, verificou-se que o feixe de raios catódicos era desviado, sempre indo na direção e sentido da placa carregada positivamente. Portanto, estas emissões possuíam cargas negativas.
Outro ponto importante é que não importava o gás utilizado, sempre ocorria o mesmo; assim Thomson chegou à conclusão lógica de que estas cargas negativas estavam presentes em toda e qualquer matéria, eram parte integrante destas. Desse modo, provou-se que, ao contrário do que Dalton havia afirmado, o átomo não era indivisível, pois possuía uma partícula subatômica negativa, que ficou denominada elétron.
Sequencialmente, em 1886, outro cientista, de nome Eugen Goldstein, descobriu os raios anódicos ou canais, que eram raios carregados positivamente, formados pelo que sobrou dos átomos do gás que teve seus elétrons arrancados pela descarga elétrica. Sabia-se que estes raios possuíam carga positiva porque eram desviados na direção oposta da dos raios catódicos, ou seja, eram atraídos pela placa negativa.
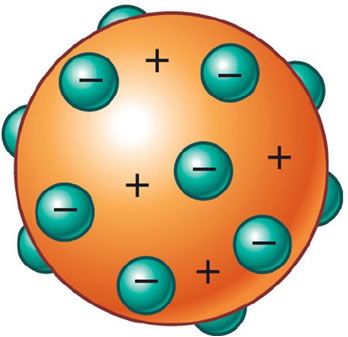
Descobriu-se então que o átomo também possuía uma parte positiva, o que inclusive era necessário para manter sua neutralidade elétrica. Desse modo, J. J. Thomson propôs um novo modelo para o átomo, apelidado de “pudim de passas” ou “pudim de ameixas”. Seria uma esfera de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula.
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola
