Forças intermoleculares no Enem são cobradas de acordo com o tópico “Materiais, suas propriedades e usos” da Matriz de Referência do Enem disponibilizada pelo Inep. As forças intermoleculares são forças de natureza elétrica e que são responsáveis pelas interações intermoleculares. As interações intermoleculares surgem quando moléculas se aproximam, originando assim repulsão ou atração. Tal tema é amplamente cobrado no Enem.
As forças intermoleculares no Enem abarcam muitos pontos importantes, como a caracterização delas, além da sua aplicação na explicação de fenômenos cotidianos. Convém saber a sua relação com as temperaturas de mudança de fase, além de saber diferenciar as forças intermoleculares quanto à força.
Leia também: Como o equilíbrio químico é cobrado no Enem?
Resumo sobre forças intermoleculares no Enem
-
As forças intermoleculares no Enem são cobradas de acordo com o tópico “Materiais, suas propriedades e usos” da Matriz de Referência do Enem.
-
As forças intermoleculares são a causa das interações intermoleculares, um processo de repulsão e atração elétrica que existe em decorrência da aproximação das moléculas.
-
Quanto mais intensas as forças intermoleculares, maiores as temperaturas de fusão e ebulição.
-
Entre as principais interações intermoleculares estão as iônicas, íon-dipolo, ligação de hidrogênio, dipolo-dipolo e dipolo induzido-dipolo induzido.
Como as forças intermoleculares são cobradas no Enem?
Segundo a Matriz de Referência do Enem, disponibilizada pelo Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira (Inep), entre os objetos de conhecimento, temos o seguinte:
Materiais, suas propriedades e usos – Propriedades de materiais. Estados físicos de materiais. Mudanças de estado. Misturas: tipos e métodos de separação. Substâncias químicas: classificação e características gerais. Metais e ligas metálicas. Ferro, cobre e alumínio. Ligações metálicas. Substâncias iônicas: características e propriedades. Substâncias iônicas do grupo: cloreto, carbonato, nitrato e sulfato. Ligação iônica. Substâncias moleculares: características e propriedades. Substâncias moleculares: H2, O2, N2, Cl2, NH3, H2O, HCl, CH4. Ligação covalente. Polaridade de moléculas. Forças intermoleculares. Relação entre estruturas, propriedade e aplicação das substâncias. (grifo nosso) |1|
Dessa forma, embora seja explícito que o tópico poderá ser cobrado no Enem, não fica claro que pontos específicos do conteúdo serão abordados. Ao se observar competências da matriz de referência, vemos algumas habilidades relacionadas ao tema:
Competência de área 5 – Entender métodos e procedimentos próprios das ciências naturais e aplicá-los em diferentes contextos.
H17 – Relacionar informações apresentadas em diferentes formas de linguagem e representação usadas nas ciências físicas, químicas ou biológicas, como texto discursivo, gráficos, tabelas, relações matemáticas ou linguagem simbólica.
H18 – Relacionar propriedades físicas, químicas ou biológicas de produtos, sistemas ou procedimentos tecnológicos às finalidades a que se destinam.
H19 – Avaliar métodos, processos ou procedimentos das ciências naturais que contribuam para diagnosticar ou solucionar problemas de ordem social, econômica ou ambiental. |2|
Ao se observar as questões que já foram utilizadas no Enem, pode-se concluir que as forças intermoleculares são importantes nos seguintes tópicos:
-
relação entre as forças intermoleculares e as temperaturas de mudança de fase;
-
identificação da força intermolecular realizada pela substância;
-
relação entre polaridade e forças intermoleculares;
-
diferenciação das forças intermoleculares quanto a sua força.
O que são forças intermoleculares?
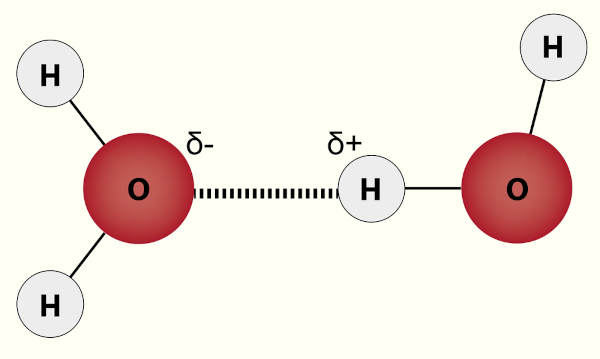
Forças intermoleculares são a causa das interações intermoleculares, um processo de repulsão e atração elétrica decorrente da aproximação das moléculas presentes. Como não há formação de ligações químicas, tal processo é bem menos energético e muito dependente da distância, sendo que quanto mais próximas as moléculas, mais intensas são as forças intermoleculares. A forma como as moléculas interagem justificam propriedades físicas e químicas das substâncias formadas, como solubilidade e temperaturas de fusão e ebulição. Para saber mais sobre as forças intermoleculares, clique aqui.
Conceitos importantes sobre forças intermoleculares para o Enem
Para o Enem, é imprescindível conhecer as principais forças intermoleculares.
-
Interações iônicas: ocorrem entre compostos iônicos, sendo uma forte atração eletrostática entre um ânion (de carga negativa) e um cátion (de carga positiva).
-
Interação dipolo-dipolo: ocorre entre moléculas polares, as quais, por conta das diferenças de eletronegatividade, apresentam um dipolo permanente (uma região positiva e uma região negativa). A interação acontece quando os dipolos de moléculas distintas se orientam para atração (o polo negativo de uma molécula se orienta para o polo positivo de outra molécula, por exemplo).
-
Ligação de hidrogênio: ocorre da mesma forma que uma interação dipolo-dipolo, contudo com algumas especificidades que a tornam mais intensa. Quando um átomo de hidrogênio está ligado a um átomo muito eletronegativo, este se coloca em um ambiente altamente eletropositivo e, assim, pode interagir com um par de elétrons isolado de outro átomo muito eletronegativo. A ligação de hidrogênio também depende da distância e, por isso, só é possível com flúor (F), oxigênio (O) e nitrogênio (N), pois, além de muito eletronegativos, possuem raio atômico pequeno.
-
Interação íon-dipolo: ocorre quando um dos polos de uma molécula polar interage com um íon, algo muito comum de ocorrer na dissolução de sais (compostos iônicos) em solventes polares.
-
Interação dipolo-dipolo induzido: moléculas apolares não apresentam dipolos permanentes, portanto moléculas polares podem, ao se aproximar destas, induzir um dipolo elétrico, ao distorcerem sua nuvem eletrônica pela ação do seu campo elétrico. A criação desse dipolo induzido permitirá a interação entre as moléculas.
-
Interação dipolo induzido-dipolo induzido: ocorre quando duas moléculas apolares, estando muito próximas, perturbam simultaneamente suas densidades eletrônicas, originando dipolos momentâneos. É a mais fraca das interações, porém é cumulativa, ou seja, quanto maior a molécula, maior a intensidade.
Com o conhecimento das interações, é possível criar uma escala de força para elas, sendo dispostas da seguinte forma em ordem crescente de força:
dipolo induzido-dipolo induzido (mais fraca) < dipolo-dipolo induzido < dipolo-dipolo < ligação de hidrogênio < íon-dipolo < interação iônica (mais forte)
É importante sempre frisar que quanto mais forte a interação intermolecular (ou força intermolecular), maiores serão as temperaturas de mudança de fase (fusão e ebulição).
Veja também: Como os cálculos estequiométricos são cobrados no Enem?
Questões sobre forças intermoleculares no Enem
Questão 1
(Enem PPL 2022) Bebidas alcoólicas, algumas soluções desinfetantes ou até álcool combustível são exemplos de misturas constituídas por etanol (CH3CH2OH) e água. A “afinidade” entre esses líquidos é suficiente para possibilitar que a mistura formada por 500 mL de água e 500 mL de etanol origine uma solução de 970 mL, em um processo que envolve liberação de pequena quantidade de energia. De certa forma, isso constitui um problema para os fabricantes, uma vez que, para obterem um litro dessa mistura, necessitariam misturar mais do que 500 mL de cada um dos líquidos.
Do ponto de vista da química, a que se deve essa variação de volume?
A) À redução do volume das moléculas.
B) Ao abaixamento da massa molecular.
C) À formação de ligações covalentes mais fortes.
D) À diminuição do grau de agitação das moléculas.
E) Ao estabelecimento de interações intermoleculares mais intensas.
Resolução:
Alternativa E.
O etanol é um álcool, função orgânica que possui o radical hidroxila (−OH). Ao se misturar com a água há o estabelecimento de ligações de hidrogênio entre essas substâncias que, por conta da intensidade, permitem uma maior aproximação das moléculas e, assim, ocasionando uma contração do volume final da mistura.
Questão 2
(Enem PPL 2020) Uma lagarta, ao comer as folhas do milho, induz no vegetal a produção de óleos voláteis cujas estruturas estão mostradas a seguir:
A volatilidade desses óleos é decorrência do(a)
A) elevado caráter covalente.
B) alta miscibilidade em água.
C) baixa estabilidade química.
D) grande superfície de contato.
E) fraca interação intermolecular.
Resolução:
Alternativa E.
Compostos voláteis possuem baixo ponto de ebulição. Os óleos são compostos orgânicos pertencentes às classes dos hidrocarbonetos que são apolares ou muito pouco polares e, por conta disso, realizam apenas interações intermoleculares do tipo dipolo induzido-dipolo induzido. Essas interações são fracas e, portanto, justificam o baixo ponto de ebulição, uma vez que as forças intermoleculares são diretamente proporcionais às temperaturas de mudança de fase.
Questão 3
(Enem PPL 2020) Um princípio importante na dissolução de solutos é que semelhante dissolve semelhante. Isso explica, por exemplo, o açúcar se dissolver em grandes quantidades na água, ao passo que o óleo não se dissolve.
A dissolução na água, do soluto apresentado, ocorre predominantemente por meio da formação de
A) ligações iônicas.
B) ligações covalentes.
C) interações íon-dipolo.
D) ligações de hidrogênio.
E) interações hidrofóbicas.
Resolução:
Alternativa D.
O açúcar (soluto) possui os radicais hidroxila (−OH), os quais realizam ligações de hidrogênio com a água (solvente). Sendo essa a mais forte interação que surge, é também a predominante na dissolução do açúcar.
Questão 4
(Enem PPL 2019) Nanopartículas de sílica recobertas com antibióticos foram desenvolvidas com sucesso como material bactericida, pois são eficazes contra bactérias sensíveis e resistentes, sem citotoxicidade significativa a células de mamíferos. As nanopartículas livres de antibióticos também foram capazes de matar as bactérias E. coli sensíveis e resistentes ao antibiótico estudado. Os autores sugerem que a interação entre os grupos hidroxila da superfície das nanopartículas e os lipopolissacarídeos da parede celular da bactéria desestabilizaria sua estrutura.
CAPELETTI, L. B. et al. Tailored Silica – Antibiotic Nanoparticles: Overcoming Bacterial Resistance with Low Cytotoxicity. Langmuir, n. 30, 2014 (adaptado)
A interação entre a superfície da nanopartícula e o lipopolissacarídeo ocorre por uma ligação
A) de hidrogênio.
B) hidrofóbica.
C) dissulfeto.
D) metálica.
E) iônica.
Resolução:
Alternativa A.
Os autores sugerem que é a interação entre os grupos hidroxila (−OH) da superfície das nanopartícuulas e os lipopolissacarídeos da parede celular da bactéria que desestabilizaria a estrutura. Os lipopolissacarídeos são compostos que, por conta da parte dos sacarídeos, também possuem grupos hidroxila, permitindo, assim, ligações de hidrogênio entre as estruturas.
Questão 5
(Enem 2019) Os hidrocarbonetos são moléculas orgânicas com uma série de aplicações industriais. Por exemplo, eles estão presentes em grande quantidade nas diversas frações do petróleo e normalmente são separados por destilação fracionada, com base em suas temperaturas de ebulição. O quadro apresenta as principais frações obtidas na destilação do petróleo em diferentes faixas de temperaturas.
SANTA MARIA, L. C. et al. Petróleo: um tema para o ensino de química. Química Nova na Escola, n. 15, maio 2002 (adaptado).
Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas porque
A) suas densidades são maiores.
B) o número de ramificações é maior.
C) sua solubilidade no petróleo é maior.
D) as forças intermoleculares são mais intensas.
E) a cadeia carbônica é mais difícil de ser quebrada.
Resolução:
Alternativa D.
Todos os derivados são feitos de hidrocarbonetos, compostos apolares muito pouco polares ou apolares. Assim, realizam interações do tipo dipolo induzido-dipolo induzido. Contudo, tal interação é acumulativa: quanto maior a molécula, mais intensa. Por isso, por mais que a natureza das interações seja a mesma para todas as moléculas, na fração 4 elas são mais intensas por conta do maior tamanho das cadeias carbônicas.
Com o maior tamanho, as forças intermoleculares se tornam mais intensas, aumentando o ponto de ebulição, justificando, assim, a maior faixa de temperatura para separação.
Notas
|1| e |2| BRASIL. Matriz de Referência Enem. Ministério da Educação, Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
BRASIL. Matriz de Referência Enem. Ministério da Educação, Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.
MIESSLER, G. L.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5. ed. Pearson Education do Brasil: São Paulo, 2014.
ROCHA, W. R. Interações Intermoleculares. Química Nova Na Escola. n. 4. mai. 2001.

