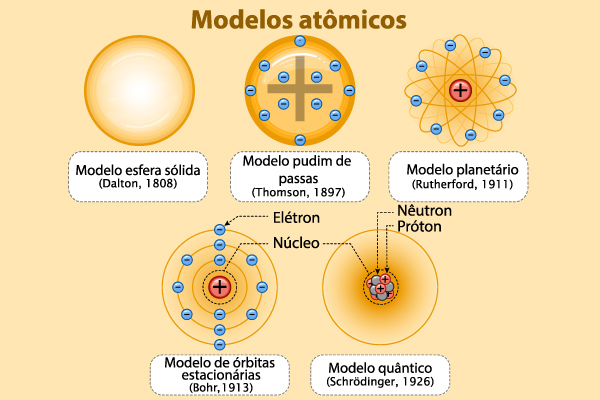
A evolução dos modelos atômicos acompanha a sociedade desde que o atomismo surgiu, no século V a.C., por meio das ideias dos filósofos Leucipo e Demócrito. De lá para cá, após muitas indas e vindas, a ciência adotou a ideia corpuscular da matéria, cujo ponto de partida científico foi, provavelmente, o modelo atômico de Dalton, utilizado para explicar o comportamento de gases atmosféricos.
A evolução dos modelos atômicos continuou a ocorrer conforme novas descobertas foram atingindo a ciência. A melhor compreensão da eletricidade permitiu que J. J. Thomson pensasse no átomo como raíz dos fenômenos elétricos, assim como a descoberta da radioatividade e da mecânica quântica revolucionou a forma de confrontarmos o átomo e sua estrutura, conforme é possível ver nos trabalhos de Rutherford, Bohr e Schrödinger.
Leia também: Afinal, o que é o átomo?
Resumo sobre a evolução dos modelos atômicos
- O átomo começou a ser pensado como uma ideia filosófica na Grécia Antiga, por meio dos filósofos Leucipo e Demócrito, por volta do século V a.C.
- Após anos de ostracismo, o atomismo volta à tona nos séculos XVII e XVIII, por meio de cientistas como Isaac Newton. É baseado nas ideias de Newton que John Dalton cria seu modelo atômico.
- Depois de Dalton, J. J. Thomson, para explicar fenômenos elétricos, apresenta um modelo atômico para justificar esse comportamento com base na partícula elementar da matéria.
- Os estudos com radioatividade do começo do século XX impulsionam mudanças na estrutura atômicas, as quais foram inicialmente observadas por Rutherford.
- Porém, concomitantemente, a mecânica quântica surgiu e a forma de se entender as partículas mudou drasticamente. Com base nisso, Bohr tenta remodelar o átomo mesclando conceitos clássicos e modernos.
- Por fim, a mecânica quântica se desenvolve e pavimenta o fim da interpretação clássica dos átomos. O matemático Erwin Schrödinger desenvolve um modelo matemático para explicar, diante de conceitos modernos, como seria a estrutura do átomo.
Como os modelos atômicos evoluíram?
Os modelos atômicos evoluíram dentro do método científico por meio de conclusões obtidas com base em experimentos que foram formulados por hipóteses que, por sua vez, foram geradas de observações de fenômenos naturais.
Embora o átomo seja a unidade básica da matéria (tudo que possui massa e volume é composto por átomos), por ser algo incapaz de ser visto até mesmo nos melhores instrumentos ópticos, ele acaba sendo compreendido de maneira indireta: com base na conclusão de experimentos científicos realizados ao longo dos anos. Tais experimentos nos ajudaram a compreender melhor a estrutura básica do átomo, mas não necessariamente correspondem à realidade, já que o átomo ainda é representado por meio de modelos.
Na ciência, os modelos são entendidos como idealizações da realidade. Assim, nem tudo do átomo é de fato conhecido, pois sempre existirão elementos da realidade que escapam do modelo. Dessa forma, é bem possível dizer que, no máximo, apenas alguns de seus aspectos estão ali representados. Devemos entender que os modelos científicos podem diferentes limites da representatividade, e se o modelo será bom ou ruim dependerá das teorias que o embasam.
Linha do tempo da evolução dos modelos atômicos
Atomismo grego
A primeira referência ao átomo está na filosofia grega, mais especificamente no atomismo, uma doutrina filosófica formulada, no começo do século V a.C., por Leucipo e seu discípulo, Demócrito de Abdera. Ambos estavam inseridos em um contexto para a solução de um problema filosófico: a busca por um princípio capaz de explicar não só a ordem do mundo como também sua origem e suas transformações. Leucipo foi discípulo de dois filósofos da escola eleática, Melissos e Zenão. O principal filósofo da escola eleática foi Parmênides, que questionava as mudanças do mundo físico, já que acreditávamos que o mundo físico era real e o real era eterno.
O atomismo foi uma solução para esse questionamento eleata. Leucipo (e, posteriormente, Demócrito), em oposição aos eleatas, acreditava na evidência dos sentidos e, assim sendo, propôs a possibilidade de conciliar as mudanças perceptíveis por nossos sentidos com algo que permaneceria sem mudanças, ou seja, inalterado. Assim, propôs a ideia de que o mundo material seria formado por infinitos entes minúsculos, os quais não poderiam ser criados, tampouco destruídos, os quais receberiam a designação de “átomos”. Dentro da concepção de Leucipo e Demócrito, os objetos que estão diante de nossos sentidos seriam, então, formados por átomos.
A palavra “átomo”, sendo então de origem grega, possui o prefixo “a-” indicando a ideia de negação e o sufixo “-tomo” sendo traduzido como “parte”. Por meio dessa correlação, “átomo” pode ser traduzido como “indivisível”.
O atomismo de Leucipo e Demócrito era um contraponto à ideia dos quatro elementos (terra, água, fogo e ar) de Empédocles, bem como à cosmologia de Aristóteles, já que, para os atomistas, não havia distinção entre a matéria celeste e a matéria terrestre.
Ao fim do século IV a.C., o atomismo sofreu uma grande contribuição do filósofo grego Epicuro, que acrescentou a noção de massa ao átomo, até então dotado apenas de forma e tamanho. Com a introdução da propriedade de peso, Epicuro tentou explicar a dinâmica de movimentação dos átomos, indicando que, em razão de seu peso, sempre se movimentariam para baixo.
Contudo, essa nova descrição do átomo trouxe um grande contraditório: no atomismo clássico, os átomos se movimentam em um Universo vazio, cujas direções são impactadas apenas por eventuais colisões ou outras ações físicas. Assim, a ideia de “em cima” e “embaixo” era mais adequada à cosmologia Aristotélica, significando, então, um problema para o átomo epicurista.
O atomismo, majoritariamente na versão epicurista, conseguiu adentrar na sociedade romana, principalmente por meio do poeta Lucrécio, autor do livro Sobre a natureza das coisas (De rerum natura). Contudo, o colapso da sociedade romana também marcou a queda do pensamento atomista.
Foi apenas no século XV, durante o renascimento cultural, que, por meio do esforço em retomar obras produzidas pela Antiguidade clássica, que o atomismo retornou. O marco, talvez, tenha sido a descoberta de manuscritos de Lucrécio em uma biblioteca de um mosteiro medieval, em 1417, por Poggio Bracciolini.
Nessa altura, a imprensa já havia surgido e, assim sendo, tais manuscritos puderam ser reproduzidos e novamente difundidos. Em parelalelo, trabalhos do filósofo grego Diógenes Laércio foram recuperados, nos quais havia a reprodução e menção de trabalhos de Epicuro. Tais atitudes foram essenciais para a difusão do atomismo na Europa renascentista.
Embora o atomismo tenha sofrido influência de outras correntes filosóficas que também foram resgatadas durante essa época, ele foi permeado por diversos nomes, como Giordano Bruno, Robert Boyle, Galileu Galilei e Isaac Newton, até que se tornasse, em definitivo, um pensamento científico nos séculos posteriores.
Modelo atômico de Dalton
As ideias atomistas permeadas na Europa renascentista foram exploradas por diversos cientistas históricos, como Isaac Newton, os quais serviram para influenciar novos cientistas que surgiam nos séculos XVII e XVIII.
Um dos cientistas influenciados pelas ideias atomistas foi o inglês John Dalton, um professor de matemática e filosofia natural com grande interesse sobre fenômenos atmosféricos, o que o levou aos estudos sobre os gases presentes na atmosfera. Isso porque, embora já se soubesse a composição química da atmosfera nessa altura, havia divergências na comunidade científica sobre a forma como os gases estariam por lá: combinados quimicamente ou apenas misturados.
Dalton, então, estava empenhado em tentar explicar como o ar atmosférico, constituído de diversos gases com densidades diferentes, poderia ser homogêneo. A saída para isso foi a criação da lei de Dalton para as pressões parciais, a ideia de que cada gás presente agiria como se fosse o único ali presente, ou seja, o aumento de um dos componentes gasosos na mistura não surtiria efeito sobre a pressão de outro componente gasoso presente. A lei de Dalton, então, afirma que a pressão total é um somatório das pressões parciais de cada componente da mistura gasosa, sendo que o número de partículas de um componente gasoso é diretamente proporcional à sua pressão parcial na mistura.
Os trabalhos de Dalton acerca da natureza das substâncias gasosas continuaram em conjunto com William Henry, no começo do século XIX, quando ambos estavam empenhados em investigar a solubilidade dos gases em água, ocasionando na lei de Henry (a solubilidade de um gás em água é diretamente proporcional à sua pressão parcial). Esses estudos foram o ponto de partida para Dalton construir a sua teoria atômica, em que o cientista buscou relacionar a solubilidade dos gases com o peso das “partículas últimas” (uma clara referência ao átomo).
John Dalton, então, determinou a lei das proporções múltiplas, em que explica a combinação de partículas últimas (os átomos) para a formação de novas partículas últimas. Por exemplo, um átomo de hidrogênio se ligaria a um átomo de oxigênio, formando um átomo composto de água. Esse átomo de água poderia então se combinar com átomos de hidrogênio ou oxigênio, formando novos átomos. Surge então, pela primeira vez, a utilização de símbolos atômicos por parte de Dalton para diferenciar os átomos.
A relação de combinação entre os átomos permitiu Dalton obter as massas atômicas relativas. Ele ainda deixou claro, na lei de proporções múltiplas, que, em diferentes átomos compostos formados pelos mesmos átomos, enquanto a massa de um átomo permanece constante, a massa do outro átomo varia em proporções de números inteiros.
Isso é possível reparar em termos modernos: por exemplo, o monóxido de carbono, CO, é formado por um átomo de carbono e um átomo de oxigênio; já no dióxido de carbono, CO2, um composto diferente formado pelos mesmos átomos, a massa de carbono permanece fixa e a massa de oxigênio dobra (uma variação de um número inteiro).
As teorias de Dalton, já defendidas por ele desde 1803 (pelo menos), foram publicadas na obra New System of Chemical Philosophy (em tradução livre, “Um novo sistema de filosofia química”), publicada em três partes (1808, 1810 e 1827). Podemos destacar alguns princípios da teoria atômica de Dalton:
- A matéria é constituída pelas partículas últimas (átomos).
- Em consonância com a lei da conservação de massas de Lavoisier, os átomos não podem ser destruídos ou criados.
- Átomos de um mesmo elemento são iguais e possuem a mesma massa.
- Átomos de elementos diferentes possuem massas diferentes.
- Em consonância com a lei das proporções fixas de Proust, átomos se unem em números fixos para formar compostos.
- Em consonância com a lei das proporções múltiplas, se compostos diferentes forem feitos pelos mesmos átomos, os números de átomos participantes respeitam uma razão de números inteiros (por exemplo, CO e CO2).
Infelizmente, cerca de 75% do acervo de John Dalton foi destruído durante a Segunda Guerra Mundial, o que dificulta precisar o ponto de partida para sua teoria atômica.
Para saber mais sobre o modelo atômico de Dalton, clique aqui.
Modelo atômico de Thomson
O cientista inglês Joseph John Thomson (J. J. Thomson) foi uma das figuras mais importantes para o desenvolvimento das teorias atômicas no fim do século XIX. Nesse século a ciência recebeu grandes contribuições no campo da eletricidade e do magnetismo, como nos trabalhos de Michael Faraday, que havia desenvolvido a eletrólise, e de James Clerk Maxwell, grande nome do magnetismo. Nesse ponto, influenciado por John Dalton, Thomson sucedeu a Lorde Reyleigh no Laboratório Cavendish, onde acabou desenvolvendo sua teoria atômica e a natureza elétrica da matéria.
O experimento que levou Thomson a descrever sua estrutura atômica foi o da investigação dos raios catódicos, utilizando-se de uma ampola de Crookes. Nesse experimento, um gás foi introduzido dentro da ampola em condições rarefeitas e, então, uma descarga elétrica foi aplicada, fazendo surgir um feixe luminoso a partir do cátodo contido na ampola (daí o nome raios catódicos).
Foi percebido que esses raios trafegaram em linha reta e, sob a ação de um campo magnético, demonstraram caráter elétrico negativo. Outro ponto importante é que os raios catódicos apresentaram massa. A natureza dois raios catódicos era sempre a mesma, independentemente das condições do experimento: Thomson chegou a utilizar quatro gases diferentes, além de três metais diferentes na constituição dos eletrodos.
Mesmo variando as condições, o cientista inglês sempre chegava à mesma relação de carga e massa (e/m), o que lhe permitiu postular que todos os elementos químicos são formados por um constituinte universal, de carga negativa e cuja massa seria cerca de 1000 vezes menor que a do átomo de hidrogênio.
Assim, Thomson teorizou acerca de uma unidade corpuscular fundamental, a qual estaria na constituição de toda matéria conhecida. Posteriormente, essa unidade corpuscular de caráter negativo recebeu o nome de elétron.
Tudo isso serviu de base para o modelo atômico proposto por Thomson, do qual é possível destacar as seguintes características:
- Os átomos dos elementos consistem em um número de corpúsculos negativos (elétrons) englobados em uma esfera de carga uniformemente positiva.
- Os elétrons circulam, em alta velocidade, em anéis coplanares e concêntricos dentro dessa esfera uniformemente positiva.
- O número de elétrons varia de anel para anel.
- Os anéis com maior número de elétrons estão mais próximos da superfície da esfera, enquanto os com menor número de elétrons estão mais internos.
O modelo de Thomson teve uma grande importância para o desenvolvimento da ciência no começo do século XX, visto que ele tinha garantias de estabilidade dentro da eletrodinâmica clássica, algo que os modelos nucleares da época, como o do cientista japonês Hantaro Nagaoka (modelo saturniano), não tinham. Nesse ponto, a estabilidade do modelo de Thomson permitiu o aprofundamento das explicações sobre ligação e reações químicas.
Para saber mais sobre o modelo atômico de Thomson, clique aqui.
Modelo atômico de Rutherford
Ernest Rutherford, físico neozelandês, começou a trabalhar no Laboratório Cavendish, da Universidade de Cambridge, mesmo local de trabalho de J. J. Thomson. Não só isso, Rutherford chegou ao laboratório pouco tempo após Thomson anunciar a descoberta dos elétrons, além do anúncio da descoberta dos raios X e da radioatividade. O físico neozelandês tinha grande interesse pelo estudo de partículas subatômicas e seu trabalho ajudou na compreensão dos fenômenos radioativos. Rutherford, por exemplo, foi responsável por nomear as partículas alfa e beta.
Posteriormente, Rutherford assumiu uma cadeira de física na Universidade McGill, no Canadá. Lá, aprofundando-se sobre o tema de radioatividade, descobriu o radônio, Rn, junto de Robert Bowie Owens, além de demonstrar que a radioatividade seria apenas a transmutação natural de alguns elementos. Também comprovou que partículas alfa, descobertas por meio da ionização produzida pelo urânio, poderiam ser desviadas por campos elétricos e magnéticos.
No começo do século XX, optou por se centrar mais no campo das pesquisas e, em 1907, mudou-se para a Universidade de Manchester. Lá ele deu prosseguimento a experimentos iniciados na Universidade McGill, onde percebeu que um feixe de partículas alfa se tornou difuso ao passar pelo ar ou por uma fina camada de mica (um mineral do grupo dos silicatos). Rutherford observou que o feixe de partículas alfa sofreu um desvio de cerca de dois graus, indicando, assim, a presença de campos elétricos e fazendo o físico supor que a matéria do átomo deveria ser a fonte de forças elétricas muito intensas.
Rutherford, com seu assistente Hans Geiger, buscou desenvolver métodos que poderiam possibilitar a contagem de partículas alfa em fenômenos radioativos, além de explicar a penetrabilidade, a permeabilidade e o espalhamento de radiações (alfa e beta) ao serem bombardeadas contra diferentes materiais.
A entrada do aluno Ernest Marsden ao grupo de pesquisa de Rutherford acabou se tornando um importante ponto no desenvolvimento de seu modelo atômico. Marsden e Geiger conseguiram desenvolver experimentos sobre o comportamento das partículas alfa e beta quando estas atravessavam a matéria, assim como seu espalhamento. Isso só foi possível graças ao desenvolvimento de métodos experimentais mais avançados para a contagem de partículas. Assim, muitos experimentos de bombardeamento de partículas alfa e beta contra finíssimas lâminas foram realizados.
Os experimentos com partículas beta não foram muito adiante, embora já se soubesse que um feixe dessas partículas poderia ser desviado por um bloco metálico. Os melhores resultados foram obtidos com partículas alfa.
Utilizando-se de métodos cintilográficos, Geiger observou que, ao se bombardear uma folha metálica com um feixe de partículas alfa, algumas dessas partículas acabavam não atravessando a folha, retornando com um pequeno ângulo de desvio. Um número menor de partículas acabava retornando com um ângulo de desvio ainda maior. O número de partículas que retornava seria maior com o aumento da massa atômica do metal.
A imprevisibilidade do experimento foi tanta que Rutherford, posteriormente, chegou a afirmar que esse resultado era equivalente a atirar um projétil naval de quinze polegadas contra uma folha de papel e ele ricochetear contra você.
Entre os metais testados como lâminas, o que apresentou melhor comportamento para tal experimento, segundo Hans Geiger, foi o ouro, já que este poderia produzir lâminas muito finas e uniformes, com maior poder de dispersão em comparação aos outros metais utilizados. Tudo isso, então, fez com que o ouro tivesse maior destaque no artigo publicado por Rutherford.
Rutherford então confessou para Geiger a sua ideia da estrutura atômica: uma estrutura nuclear que concentraria quase toda a massa do átomo, mas com apenas um milésimo do tamanho dele. Nessa estrutura nuclear, haveria um único tipo de carga. Em 1911, Rutherford comunicou, baseado nos experimentos realizados por Geiger e Marsden, suas ideias para a estrutura atômica para a Sociedade de Literatura e Filosofia de Manchester. Em maio do mesmo ano, Rutherford publicou suas ideias na Philosophical Magazine.
Assim, é possível concluir que o átomo de Rutherford seria uma carga central concentrada circundada por uma distribuição elétrica uniforme com carga elétrica oposta, de mesma intensidade. Rutherford ainda disse que a carga central do átomo seria aproximadamente proporcional a sua massa.
O modelo de Rutherford poderia ser comparado ao modelo saturniano do cientista japonês Hantaro Nagaoka, que propôs um átomo com uma massa central circundada por anéis de elétrons em rotação, tal qual o planeta Saturno. Rutherford, entretanto, não fez afirmações acerca da natureza elétrica das regiões central e periférica do seu átomo, apenas concluindo que elas deveriam ser opostas. A determinação e confirmação da carga central positiva do átomo foi posterior, a partir de 1913, por meio de experimentos realizados por Ernest Marsden, os quais foram propostos por Rutherford. O nome próton, inclusive, foi dado pelo neozelandês.
Contudo, ambos os modelos apresentavam grandes problemas de estabilidade. Nagaoka, por exemplo, dizia que o seu átomo poderia ser estável se a força atrativa entre as cargas fosse grande. A instabilidade eletrodinâmica do modelo de Rutherford levou a uma rejeição inicial. Algumas publicações acerca do tema tiveram baixo impacto. Vale dizer que Rutherford chegou à sua proposta atômica para explicar o espalhamento de partículas alfa ao atravessarem lâminas metálicas, algo totalmente inesperado, mas com uma base experimental muito sólida.
Para saber mais sobre o modelo atômico de Rutherford, clique aqui.
Modelo atômico de Bohr
Apesar de ser baseado no modelo atômico de Rutherford, o modelo atômico proposto por Niels Bohr recebeu maior aceitação por um simples motivo: focou-se na dinâmica dos elétrons, sua distribuição, propriedades, entre outros. No começo do século XX, os físicos da área tentavam explicar a estrutura do átomo, buscando entender a relação deste com os fenômenos elétricos, assim como elucidar os mecanismos de ligação química e a tabela de Mendeleev.
O modelo de Bohr começou a ser divulgado em julho de 1913, por meio de um artigo publicado em três partes na Philosophical Magazine, intitulado “Sobre a constituição de átomos e moléculas”. Nesse artigo, Bohr fez uma discussão acerca dos modelos de Thomson e Rutherford, explicitando suas opiniões acerca da estabilidade de ambos.
Ao optar pelo modelo de Rutherford, Bohr foi enfático ao afirmar que a eletrodinâmica clássica não seria capaz de explicar o comportamento de sistemas de dimensões atômicas, havendo então a necessidade da introdução de conceitos mais modernos, como os trazidos por Max Planck, em que se afirmava que sistemas atômicos não irradiavam energia de forma contínua (o que era esperado pelas leis clássicas da eletrodinâmica), mas sim por emissões distintas e separadas.
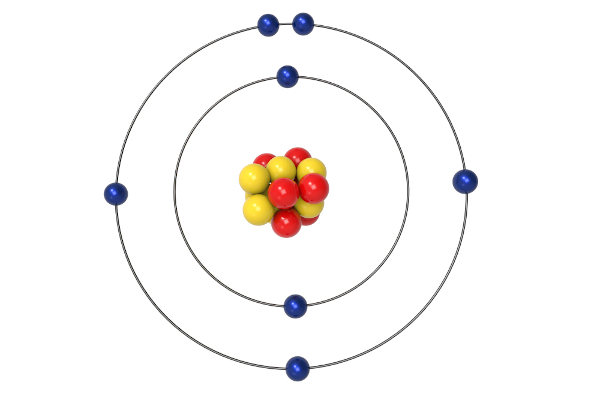
O ponto de partida de discussão teórica e fundamental para o modelo de Bohr eram as linhas espectrais de emissão do átomo de hidrogênio, obtidas pela técnica de espectroscopia. Com base em todo esse arcabouço teórico, Bohr afirmou que não haveria radiação de energia, mas sim que os elétrons descreveriam órbitas elípticas e estacionárias (posteriormente conhecidas como níveis de energia). Dessa forma, resolveu as questões de instabilidade do modelo atômico de Rutherford.
Segundo o que foi proposto por Bohr, o equilíbrio dinâmico dessas órbitas estacionárias e elípticas dos elétrons poderia ser explicado pela mecânica clássica, porém a passagem dos elétrons por esses estados estacionários não. Além disso, a passagem de elétrons entre os níveis de energia estacionários seria acompanhada da emissão de uma radiação homogênea, a qual poderia ser prevista pela teoria de Planck. De modo mais simples, Bohr estava descrevendo a ideia de transição eletrônica, que seria uma ideia da movimentação dos elétrons na estrutura atômica e que justificaria as linhas espectrais.
Tais observações estão dentro dos famosos postulados de Bohr, utilizados para explicar o comportamento do átomo sob sua perspectiva teórica e experimental:
- A energia não é emitida ou absorvida de forma contínua, conforme estipulado pela eletrodinâmica clássica. Assim sendo, essa emissão ou absorção de energia só ocorrerá durante a passagem de elétrons entre os estados estacionários. Basicamente, o elétron pode “saltar” para um nível estacionário mais externo por meio da absorção de uma quantidade específica de energia, determinada pela equação E = hν, em que “E” é a energia, “h” é a constante de Planck e “ν” é a frequência. Essa energia será emitida quando o elétron retornar ao seu nível estacionário original (ou fundamental).
- Os estados estacionários constituídos por elétrons em torno do núcleo positivo teriam a condição de apresentar um momento angular que seria múltiplo inteiro do número h/2π, em que “h” é a constante de Planck. Isso quer dizer, em termos simples, que nem todas as órbitas para elétrons em torno do núcleo seriam possíveis, o que iria contra a ideia de homogeneidade das órbitas de elétrons prevista pela mecânica clássica.
- O movimento dos elétrons em torno do núcleo nesses níveis estacionários, além da atração elétrica entre elétron e núcleo, o que configura o equilíbrio dinâmico dos sistemas atômicos, poderia ser explicado pela mecânica clássica.
- Já nessas órbitas estacionárias, os elétrons, apesar de constantemente acelerados, apresentariam energia total constante, sem emissão de energia ou radiação eletromagnética.
Pelos seus estudos, Niels Bohr recebeu o Prêmio Nobel de Física de 1922. O modelo atômico de Bohr é um esforço para apresentar uma utilização simultânea da mecânica clássica e da mecânica quântica.
Para saber mais sobre o modelo atômico de Bohr, clique aqui.
Modelo atômico de Schrödinger (modelo quântico)
O modelo de Bohr logo sofreu alterações, muito por conta das extensas publicações sobre mecânica quântica após a apresentação de seu modelo. A melhor compreensão da matéria acabou demonstrando sérias limitações do modelo de Bohr para explicar átomos polieletrônicos (ou seja, com dois ou mais elétrons).
Dois princípios teóricos apresentados são tidos como fundamentais: a dualidade onda-partícula, apresentada por Louis de Broglie, a qual diz que as partículas também apresentariam comportamento ondulatório, e o princípio da incerteza, trazido por Werner Heisenberg, em que a determinação da trajetória de uma partícula não seria tão precisa, uma vez que ela apresentaria comportamento de onda e, afinal, não faz sentido falar da localização de uma onda.
Com base nisso, o cientista austríaco Erwin Schrödinger, em 1927, utilizou-se de tais princípios teóricos para explicar o comportamento das partículas dentro dos átomos, substituindo a certeza da trajetória das partículas por funções de onda, representada pela letra grega psi (ψ), cujos valores se alteravam de acordo com a posição. Para melhor compreensão, pense nas funções seno e cosseno, por exemplo, as quais também são funções de onda, cujos valores variam de acordo com a posição.
Schrödinger não necessariamente trouxe um novo modelo atômico, mas sim uma explicação matemática para o que vinha sendo observado acerca da natureza das partículas. A resolução das funções de onda, por meio de uma equação proposta pelo próprio Schrödinger (Hψ = Eψ, em que “H” é um operador matemático conhecido como “hamiltoniano” e “E” é a energia), trouxe a conclusão de que as partículas não poderiam apresentar qualquer energia, mas apenas valores específicos de energia.
Em termos do átomo, podemos entender que as funções de onda dos elétrons são os orbitais atômicos, regiões de probabilidade de existência de elétrons. A resolução das funções de onda dos elétrons pela equação de Schrödinger traz os seus valores de energia, assim sendo, comprova-se que os elétrons não poderiam ter qualquer nível de energia, mas níveis específicos de energia (daí a expressão níveis de energia).
Por isso, é possível dizer que Schrödinger foi essencial para entender, diante dos resultados obtidos para a mecânica quântica, acerca da estrutura atômica. Um grande diferencial, sem dúvida alguma, é que era possível adicionar parâmetros relativos à repulsão eletrônica em sua equação.
Com isso, a equação de Schrödinger também se aplicava aos átomos polieletrônicos, algo não possível até então. Para complementar, Max Born trouxe a ideia de que o quadrado da função de onda, ψ², apresentaria a densidade de probabilidade dos elétrons em um orbital atômico, assim sendo, uma maior compreensão de como os elétrons ocupariam tais orbitais atômicos.
Para saber mais sobre o modelo atômico de Schrödinger, clique aqui.
Exercícios resolvidos sobre evolução dos modelos atômicos
Questão 1
(Unieva) Considere o seguinte experimento: um feixe de partículas alfa (núcleos de hélio) é disparado contra uma fina folha de ouro. A maioria das partículas alfa atravessa a folha sem desvio, mas algumas sofrem desvios significativos ou são refletidas de volta.
Com base nesse experimento e na teoria atômica atual, qual das seguintes afirmações é verdadeira?
A) Os átomos são maciços e indivisíveis.
B) O núcleo do átomo é pequeno e denso em comparação com o tamanho do átomo.
C) Os elétrons estão uniformemente distribuídos em todo o átomo.
D) Os prótons e os elétrons têm massas iguais.
Resolução:
Alternativa B.
Apesar das evoluções na compreensão do modelo atômico, ainda se mantém a ideia de que o núcleo atômico é muito pequeno em comparação à sua extensão, além de ser altamente denso.
Questão 2
(UEMG) Átomo é a partícula que forma todas as matérias e vem sendo estudada há milênios por filósofos, alquimistas, físicos e químicos. Porém, o átomo é uma partícula tão minúscula, que nem com os avanços tecnológicos desenvolveu-se um microscópio que seja possível fazer sua visualização. Por isso, os cientistas desenvolveram modelos atômicos, como base em seus experimentos, para explicar como seria tal partícula de acordo com seus estudos.
Dos cientistas, qual tem o modelo atômico mais recente?
A) Rutherford.
B) Dalton.
C) Bohr.
D) Thomson.
Resolução:
Alternativa C.
Dos cientistas citados, o que fez estudos mais recentes acerca da estrutura atômica foi o dinamarquês Niels Bohr, logo após os trabalhos de Rutherford, no começo do século XX.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CHAVES, L. M. M.; DOS SANTOS, W. L. P.; CARNEIRO, M. H. S. História da ciência no estudo de modelos atômicos em livros didáticos e Química e concepções de Ciência. Química Nova na Escola. v. 36, n.4, p. 269-279, nov. 2014.
DA SILVA, F. S.; CATELLI, F. Os modelos na ciência: traços da evolução histórico-epistemológica. Revista Brasileira de Ensino de Física. v. 41, n. 4, mai. 2019.
DE ALMEIDA, W. B.; DOS SANTOS, H. F. Modelos teóricos para a compreensão da estrutura da matéria. Química Nova na Escola. n. 4, mai. 2001.
DIAS, L. M.; SOARES, V. P.; TOLEDO, E. J. L. O modelo atômico de Thomson em livros de Química: desafios e perspectivas. Química Nova na Escola. p. 1-10, 2024.
FILGUEIRAS, C. A. Duzentos anos da teoria atômica de Dalton. Química Nova na Escola. n. 20, nov. 2004.
LOPES, C. V. M. Modelos atômicos no início do século XX: da física clássica à introdução da teoria quântica. 2009. Tese (Doutorado em História da Ciência) – Pontíficia Universidade Católica de São Paulo, São Paulo, 2009.
LOPES, C. V. M.; MARTINS, R. A. J. J. Thomson e o uso de analogias para explicar os modelos atômicos: o ‘Pudim de Passas’ nos livros texto. Encontro Nacional de Pesquisa em Educação em Ciências. 8 nov. 2009.
MIESSLER, G. L.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5. ed. São Paulo: Pearson Education do Brasil, 2014.
PEREIRA, L. S.; SILVA, J. L. P. B. Uma história do Antiatomismo: Possibilidades para o Ensino de Química. Química Nova na Escola. v. 40, n. 1, p. 19-24, fev. 2018.
PORTO, C. M. O atomismo grego e a formação do pensamento físico moderno. Revista Brasileira de Ensino de Física. v. 35, n. 4, 4601, out. 2013.
RAMOS, T. C.; MOZZER, N. B. Análise do uso da analogia com o “Pudim de Passas” guiado pelo TWA no ensino do modelo atômico de Thomson: considerações e recomendações. Química Nova na Escola. v. 40, n. 2, p. 106-115, mai. 2018.
VIANA, H. E. B.; PORTO, P. A. O processo de elaboração da teoria atômica de John Dalton. Química Nova na Escola. n. 7, dez. 2007.