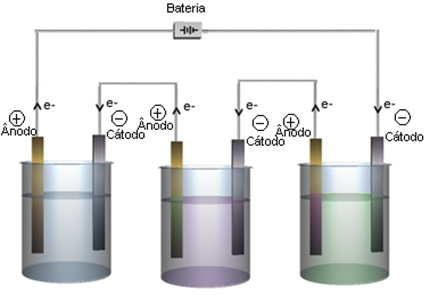
A eletrólise geralmente é estudada em Eletroquímica como sendo um sistema que contém uma cuba ou célula eletrolítica (um recipiente) com uma substância líquida ou em solução, na qual ficam mergulhados dois eletrodos (o cátodo ou polo negativo e o ânodo ou polo positivo). Tais eletrodos ficam conectados a um gerador (pilha ou bateria) que, ao ser ligado, conduz eletricidade de um eletrodo a outro por meio do líquido, originando reações de oxirredução que transformam a energia elétrica em energia química.
No entanto, quando a eletrólise é aplicada em indústrias, na prática não se usa apenas uma cuba eletroquímica com dois eletrodos; mas sim vários tanques enormes ligados em série, como mostrado na imagem inicial. Além disso, usa-se apenas um gerador com capacidade suficiente para atender a todos esses tanques, pois se fosse usado um gerador para cada tanque, o prejuízo econômico inviabilizaria a produção industrial.
No texto Aspectos Quantitativos da Eletrólise foi mostrado que por meio da fórmula da carga elétrica (Q = i . t) e por meio da relação da constante de Faraday (96500 C) com as massas molares das substâncias e com as semirreações catódica e anódica balanceadas, é possível determinar a massa da substância que foi transformada ou obtida numa cuba eletrolítica.
Isso também pode ser feito no caso da eletrólise em série. Mas há dois fatores que devem ser levados em consideração:
1. Visto que o gerador é um só para todas as cubas eletrolíticas, o tempo (t) e a intensidade da corrente elétrica (i) serão os mesmos para todas as cubas. Portanto, a carga elétrica (Q) também será a mesma para todas as células;
2. A massa obtida ou transformada em cada célula será diferente, visto que as substâncias contidas em cada uma são distintas. Isso acontece porque, por exemplo, o íon Zn2+ exige o dobro de elétrons que o íon Ag1+. Essas massas podem ser calculadas por meio de regras de três ou diretamente pela fórmula abaixo:
m = __M . Q__
q . 96500
Em que:
M = massa molar de cada substância;
Q = carga elétrica do sistema;
q = cargas dos íons, por exemplo, se o íons forem Ag1+, o valor de q será 1.
Veja um exemplo de como realizar esse tipo de cálculo:
Exemplo: Há três cubas eletrolíticas ligadas em série, contendo respectivamente AgNO3, CuSO4 e ZnCℓ2. Sabendo-se que na primeira cuba foram depositadas 108 g de prata metálica, pode-se concluir que foram depositados também:
a)31,75 g de cobre metálico.
b)65,4 g de zinco metálico.
c)63,5 g de cobre metálico.
d)108 g de cobre metálico.
e)108 g de zinco metálico.
(Massas atômicas: Ag = 108; Cu = 63,5; Zn = 65,4).
Resolução:
A partir da massa encontrada na primeira cuba eletrolítica podemos descobrir a carga elétrica do sistema, que é a mesma para todas as cubas:
Ag+ + 1e-→ Ag
↓ ↓
1 mol 1 mol
1mol . 96500 C ----- 108 g (massa molar)
Q ----- 108 g (massa obtida)
Q = 96500 C
Com esse valor em mãos, podemos descobrir as massas dos outros metais. Isso pode ser feito por meio de regra de três ou pela fórmula que foi dada anteriormente:
- Por regra de três:
2ª Cuba eletrolítica: 3ª Cuba eletrolítica:
Cu2+ + 2e-→ Cu Zn+2 + 2e-→ Zn
↓ ↓ ↓ ↓
2 mol 1 mol 2 mol 1 mol
2. 96500 C ----- 63,5 g 2. 96500 C ----- 65,4 g
96500 C---------- mCu 96500 C---------- mZn
mCu = 31, 75 g mZn = 32,7 g
- Pela fórmula: m = __M . Q__
q . 96500
2ª Cuba eletrolítica: 3ª Cuba eletrolítica:
mCu = (63,5). (96500) mZn = (32,7). (96500)
2 . 96500 1 . 96500
mCu = 31, 75 g mZn =32,7 g
Portanto, a alternativa correta é a letra “a”.
Por Jennifer Fogaça
Graduada em Química
