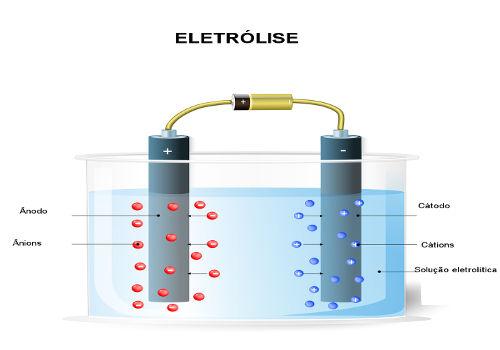
A eletrólise da água consiste na decomposição dessa substância por meio de corrente elétrica e do acréscimo de um eletrólito. Vamos entender melhor como isso ocorre?
Leia também: O que é eletrólise?
Como acontece a eletrólise da água?
As moléculas de água são capazes de sofrer uma autoionização, gerando os íons H+ (ou H3O+) e OH-:
H2O ↔ H+ + OH-
ou
2 H2O ↔ H3O+ + OH-
No entanto, a água é um eletrólito muito fraco e, apesar de possuir esses íons, ela não consegue conduzir corrente elétrica. Assim, para realizar a sua eletrólise, isto é, a sua decomposição por meio de corrente elétrica, é necessário acrescentar um eletrólito, um soluto iônico que pode ser um sal, uma base ou um ácido.

Ordem de prioridade para descarga seletiva
Todavia, conforme explicado no texto Eletrólise aquosa, nesse caso, não teremos somente os íons provenientes da água, mas também os da substância que foi dissolvida nela. Na eletrólise, somente um cátion e um ânion sofrem descarga no eletrodo, ou seja, é uma descarga seletiva que segue uma ordem de prioridade.
Assim, para que o cátodo e o ânodo que sofrerão a descarga sejam os da água, e não os da substância dissolvida, é preciso escolher um ácido, uma base ou um sal cujos íons tenham menos facilidade para sofrer descarga nos eletrodos do que os íons da água. Para tal, precisamos consultar a fila de prioridade mostrada a seguir:
Observe que os cátions listados abaixo do H+ possuem menos facilidade de descarga do que ele. Na tabela à direita, vemos que os ânions abaixo do OH- possuem menos facilidade de descarga. Portanto, podemos escolher, por exemplo, um sal, uma base ou um ácido que forme os íons Na+, K+, NO3-, SO42- e assim por diante, além de formar também os mesmos íons da água, ou seja, H+ e OH-. Alguns exemplos são: ácido sulfúrico (H2SO4), hidróxido de sódio (NaOH) e o nitrato de potássio (KNO3).
Exemplo com as reações ocorridas na eletrólise da água
Digamos que seja realizada uma eletrólise da água com a adição do ácido sulfúrico. Nesse caso, teremos a formação dos seguintes íons no meio:
-
Dissociação do ácido: 1 H2SO4 → 2 H+ + 1 SO42-
-
Autoionização da água: H2O → H+ + OH- ou 2 H2O → H3O+ + OH-
Observe que o único cátion existente é o H+, portanto é ele que sofrerá redução (ganho de elétrons) no eletrodo negativo (cátodo) e produzirá gás hidrogênio (H2).
Agora, falando dos ânions, existem dois ânions no meio, que são o SO42- e o OH-. Conforme a tabela acima mostra, o SO42- é mais reativo e possui menos facilidade de descarga. Desse modo, o OH- sofrerá descarga, oxidando-se (perdendo elétrons) no eletrodo positivo (ânodo) e produzirá gás oxigênio (O2):
-
Semirreação do cátodo: 4 H3O+ + 4 e- → H2O + H2
-
Semirreação do ânodo: 4 OH- → 2 H2O + 1 O2 + 4 e-
Somando todo esse processo, chegamos à equação global:
-
Ionização da água: 8 H2O → 4 H3O+ + 4 OH-
-
Semirreação do cátodo: 4 H3O+ + 4 e- → 4 H2O + 2 H2
-
Semirreação do ânodo: 4 OH- → 2 H2O + 1 O2 + 4 e-
-
Equação global: 2 H2O → 2 H2 + 1 O2
Observe que o volume de hidrogênio produzido é duas vezes maior que o de oxigênio. No entanto, na prática, não se verifica essa proporção rigorosa porque o oxigênio é mais solúvel que o gás hidrogênio.
Leia também: Obtenção de alumínio por meio de eletrólise
Aplicações da eletrólise da água
A eletrólise da água é um processo muito importante, tendo em vista que o hidrogênio é um gás que pode ser usado como combustível. Como os combustíveis derivados do petróleo não são renováveis, o gás hidrogênio pode tornar-se uma alternativa importante.
Além disso, já existem métodos de produção da gasolina que usam o processo de eletrólise da água. Veja como isso é feito no texto Cientistas conseguem transformar gás carbônico em gasolina.
Por Jennifer Fogaça
Professora de Química