Visto que existem exceções à regra do octeto, como podemos saber qual é o arranjo correto entre os átomos na formação de uma molécula?
Isso pode ser feito por meio do cálculo da carga formal de cada estrutura. A carga formal que estiver mais próxima de zero será a que possui maior probabilidade de existência real. Note que é “mais próximo de zero”, portanto, não precisa ser igual a zero.
A fórmula da carga formal (Cfo) é:
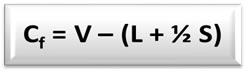
V = quantidade de elétrons de valência do átomo livre;
L = quantidade de elétrons presentes nos pares isolados (não ligantes) do átomo na estrutura;
S = quantidade de elétrons compartilhados pelo átomo na estrutura.
Para entender como isso ocorre, imagine que queremos saber qual é a estrutura eletrônica de Lewis para a molécula de SO2. Temos duas possibilidades de arranjos entre os átomos:
Calcula-se a carga formal de todos os átomos participantes das estruturas. Veja:
1ª Possibilidade:
Enxofre (S): Oxigênio (O) Oxigênio (O)
Cf(S) = 6 – (2 + ½ 8) Cf(S) = 6 – (4 + ½ 4) Cf(S) = 6 – (4 + ½ 4)
Cf(S) =0 Cf(S) =0 Cf(S) =0
2ª Possibilidade:
Enxofre (S): Oxigênio (O) Oxigênio (O)
Cf(S) = 6 – (2 + ½ 6) Cf(S) = 6 – (6 + ½ 2) Cf(S) = 6 – (4 + ½ 4)
Cf(S) = +1 Cf(S) = -1 Cf(S) =0
Com base nos resultados obtidos, podemos notar que a 1ª estrutura é a que tem maior probabilidade de existência real. Assim, sabemos que ela não segue a regra do octeto, mas que o enxofre expandiu sua camada de valência, ficando estável com 10 elétrons.
Essa regra vale também para descobrir qual é o arranjo correto de íons.
Por Jennifer Fogaça
Graduada em Química
