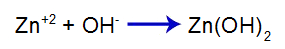
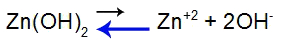
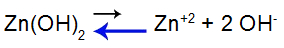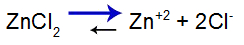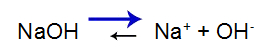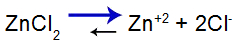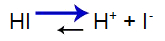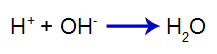O que é uma solução-tampão?
O que é uma solução-tampão? Trata-se de uma mistura formada por um ácido fraco ou uma base fraca juntamente a um sal, a qual não apresenta grandes alterações do pH.
Imprimir
Texto:
A+
A-
Escrito por: Diogo Lopes Dias
Escritor oficial Brasil Escola
De estudante para estudante
Mande sua pergunta
Artigos Relacionados
Equações de dissociação de sais inorgânicos
Clique a aprenda como devem ser construídas as equações de dissociação de sais inorgânicos.
Química
Equações de dissociação das bases
Aprenda a forma correta de construir as equações de dissociação das bases!
Química
Força dos ácidos
Confira algumas maneiras simples e fáceis de determinar a força dos ácidos.
Química
A força ou grau de dissociação das bases
Descubra como é medida a força das bases segundo o seu grau de dissociação iônica.
Química
Grau de hidratação dos ácidos
Aprenda a realizar a nomenclatura dos ácidos de acordo com o grau de hidratação.
Química
Efeito do íon comum
Entenda como o efeito do íon comum interfere no deslocamento do equilíbrio químico, na constante do equilíbrio e no pH do meio.
Química
Solução-tampão no sangue humano
Solução-tampão é uma solução que contém, geralmente, um ácido fraco com sal desse ácido, ou uma base fraca com um sal dessa base.
Química
Classificação das Bases
Número de hidroxilas, solubilidade e grau de dissociação de bases.
Química
Classificação dos ácidos
Conheça os principais critérios utilizados na classificação dos ácidos.
Química
Classificação dos Sais
Como distinguir um sal pela natureza de seus íons?
Química
PUBLICIDADE