O que é massa atômica?
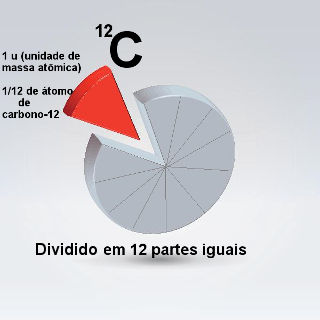
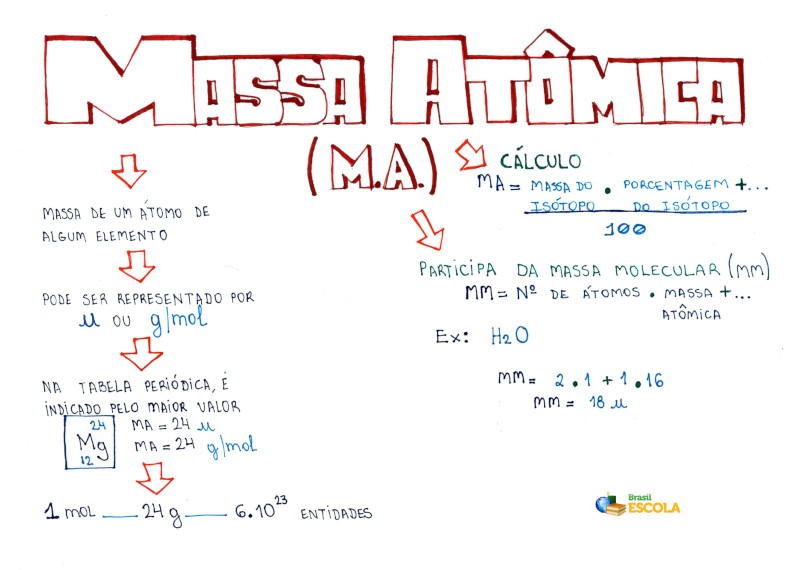
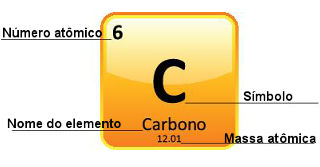
A massa atômica corresponde a um doze avos da massa de um átomo de carbono-12, isto é, cuja massa atômica é 12.

Imprimir
Texto:
A+
A-
Escrito por: Jennifer Rocha Vargas Fogaça
Escritor oficial Brasil Escola
De estudante para estudante
Mande sua pergunta
Artigos Relacionados
O que é constante de Avogadro?
Descubra o que é constante de Avogadro e aprenda como esse valor numérico pode ser utilizado para realizar diversos cálculos fundamentais na Química.
O que é Química?
O que é modelo de Rutherford?
Saiba o que é o modelo atômico de Rutherford e compreenda como esse cientista conseguiu descobrir algumas características importantes do átomo.
O que é Química?
O que é número atômico?
Veja o que é o número atômico dos elementos químicos, sua representação e como ele afeta o comportamento dos elementos.
O que é Química?
O que é número de massa?
Clique e saiba o que é número de massa e aprenda como ele está relacionado aos prótons e nêutrons de um átomo.
O que é Química?
Massas dos átomos
As massas dos átomos, expressas em massa atômica de um átomo, de um elemento e da massa molécula ou massa-fórmula, são medidas em unidade de massa atômica (u).
Química
Massa molecular
Clique aqui, saiba como calcular a massa molecular, conheça sua unidade de medida e descubra a diferença entre massa molecular e massa molar.
Química
PUBLICIDADE